引物的基本知识
PCR扩不出可以让引物背锅吗?
基本不可能是引物本身问题,可能是设计问题。
引物是怎么合成的?
目前引物合成基本采用固相亚磷酰胺三酯法,具有高效、快速的偶联以及起始反应物比较稳定的特点。亚磷酰胺三酯法是将DNA固定在固相载体上完成DNA链的合成的,合成的方向是由待合成引物的3′端向5′端,相邻的核苷酸通过3′→5′磷酸二酯键连接。
通过氨水高温处理,连接在CPG上的引物被切下来,通过OPC, PAGE等手段纯化引物,成品引物用C18浓缩、脱盐,沉淀。沉淀后的引物用水悬浮,测定OD260定量,根据定单要求分装。
引物的设计原则
- 长度一般在18-35mer。
- G-C含量控制在40-60%左右。
- 避免近3’ 端有酶切位点或发夹结构。
- 避免3’端最后5个碱基有2个以上的G或C。
- 如果可能避免在3’端最后1个碱基为A。
- 避免连续相同碱基的出现,特别是要避免GGGG或更多G出现。
- 退火温度Tm控制在58-60℃左右(低,以保证引物同目的序列有效退火,高,以减少非特异性结合)。
- 如果是设计点突变引物,突变点应尽可能在引物的中间。
最长可以合成多长的引物?
引物越长,出现问题的概率就越大。有的公司合成过120base的引物,产率很低。除非需要,建议合成片段长度不要超过80mer,按照目前的引物合成效率,80mer的粗产品,全长(还不一定正确)引物的百分比不会超过40%,后续处理还有丢失很多,最后的产量很低。
注意,引物合成中发生错误的频率,比任何高保真高温聚合酶PCR扩增过程所产生的频率都要高。所以做引物合成,尤其长链引物合成,要有可能有突变的思想准备。
引物的检验
| 参数 | 理想范围/阈值 | 超标风险 | 优化工具 |
|---|---|---|---|
| Tm值 | 55–65℃(ΔTm≤2℃) | 假阴性/非特异扩增 | 梯度PCR、Tm计算器 |
| GC含量 | 40–60%(ΔGC≤10%) | 二级结构/结合不稳定 | 调整引物序列 |
| Self complementarity | ΔG > -4.5 kcal/mol | 发夹结构阻碍结合 | Oligo软件、Primer-BLAST |
| Self 3’ complementarity | 评分<4.5,互补碱基≤2 bp | 引物二聚体/非特异延伸 | Primer-BLAST |
3’-complementarit可用于预测引物二聚体,而Self-complementarity评分可用于预测引物本身甚至引物对之间可能的二级结构。self 3’ complementarity 严格<1/4碱基数,越低越好。
如何检测引物的纯度?
实验室方便的作法是用PAGE方法。使用加有7M尿素的16%的聚丙烯酰胺凝胶进行电泳。取0.2-0.5OD的引物,用尿素饱和液溶解或引物溶液中加入尿素干粉直到饱和,上样前加热变性(95℃,2mins)。加入尿素的目的一是变性,二是增加样品比重,容易加样。
600V电压进行电泳,一定时间后(约2-3小时),剥胶,用荧光TLC板在紫外灯下检测带型,在主带之下没有杂带,说明纯度是好的。如果条件许可,也可以用EB 染色或银染方式染色。
拿到引物之后
如果是粉末:干燥后的引物质地非常疏松,开盖前最好离心一下,或管垂直向上在桌面上敲敲,将引物粉末收集到管底。根据计算出的体积加入去离子无菌水或10mM Tris pH7.5缓冲液,室温放置几分钟,振荡助溶,离心将溶液收集到管底。溶解引物用的水一般不要用蒸馏水,因为有些蒸馏水的pH值比较低(pH4-5),引物在这种条件下不稳定。
引物在溶解前,室温状态下可以长期保存。溶解后的引物-20度可以长期保存。如果对实验的重复性要求较高,合成的OD数较大,建议分装,避免反复冻融。修饰荧光引物需要避光保存。
注意:如果溶解引物的水PH过低或污染了菌或核酸酶,会使引物降解。使用时没有充分解冻混合,液体不均匀也可能会造成引物加入量不准确。建议使用10mMT ris pH7.5缓冲液溶解引物,因为有些蒸馏水的pH值比较低(pH4-5), 引物在这种条件下不稳定。
引物合成的修饰
合成的引物5’ 为羟基,没有磷酸基团。要求引物合成公司合成时直接在5′或3′端进行磷酸化需要另外收费。
引物5’端缺乏磷酸基团(未磷酸化)完全不影响其在常规PCR扩增中的功能,但会显著阻碍需要酶切或连接的应用(如TA克隆、连接酶依赖性NGS文库构建)。
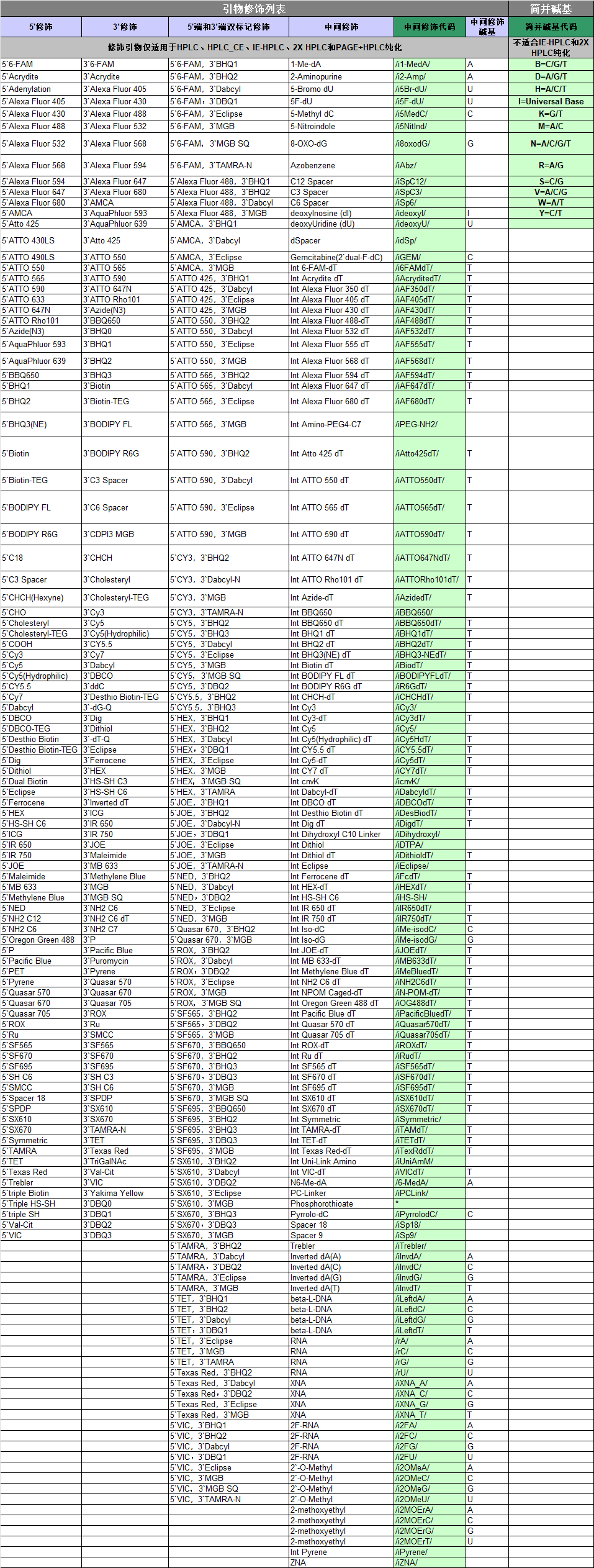
生工公司的引物修饰列表:
引物提交时需要注意的问题
定量引物的单位(来自知乎)
在引物订购和浓度标定中,光密度值(Optical Density, OD)作为关键参数被广泛使用。寡核苷酸的定量方式因供应商而异。主要测量单位有OD、摩尔(mol、μmol\nmol等)和摩尔浓度(nmol/ml或μM等)。
寡核苷酸中的光密度(OD或OD260)
OD是一个没有单位的密度参数。作为定量分析寡核苷酸浓度的常用方法,该技术基于溶液中物质对光的散射特性。通过比尔-朗伯定律,可利用该物理特性计算溶液密度。该定律描述了溶液中物质浓度与光通过溶液时散射程度之间的定量关系。溶液中寡核苷酸浓度越高,光散射效应越显著。
比尔-朗伯定律:A = Ɛlc
A = 吸光度,Ɛ = 消光系数,l = 光程长度,c = 摩尔浓度(单位:mol/L)
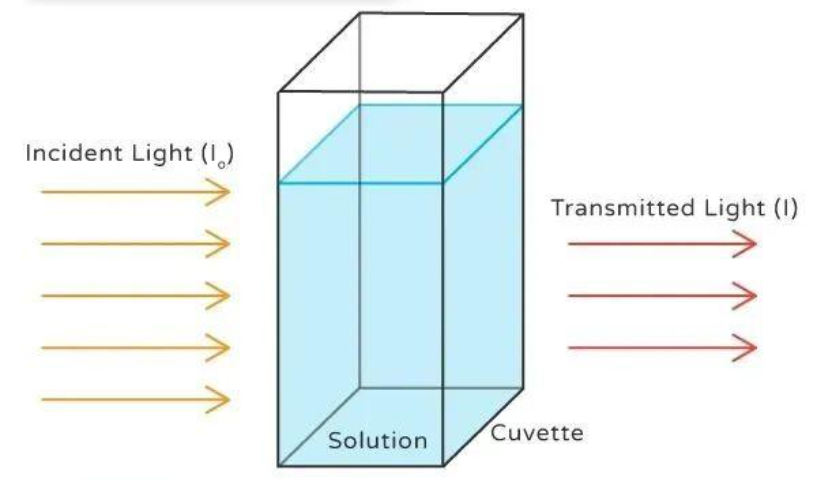
吸光度通过分光光度计进行测量,光程长度特指分光光度计中装载样品的比色皿宽度,标准比色皿宽度为1厘米。使用OD法测定浓度的局限性在于,每种物质对光的散射特性具有特异性。为校正这种物质特异性差异,需引入消光系数(Ɛ)变量用于浓度计算。每个寡核苷酸都具有独特的消光系数(Ɛ),且该数值会随波长改变。必须确保使用与测量吸光度时相同波长对应的消光系数值。即使两种寡核苷酸长度相同,其特异性序列也会影响消光系数。因此,两个OD值为1的寡核苷酸可能具有显著差异的实际浓度。
在寡核苷酸中,OD值可以定义为在260nm波长下,使用1 cm光程的石英比色皿,1 mL水溶液中的吸光度为1(Absorbance, A)。1 OD值对应的单链DNA质量约为33 μg。
- 常规PCR扩增:1 OD引物可完成200-500次50 μL反应。
- 基因拼接或连接反应:仅需0.5-1 OD即可满足实验需求。
- 长片段合成(如全基因合成):由于合成效率较低,需适当增加OD数(如5~10 OD)以补偿损耗。
估算:
- ssDNA:1 OD≈33 μg
- dsDNA:1 OD≈50 μg
- 单链RNA:1 OD≈40 μg
注意:引物越长,Ɛ越大。
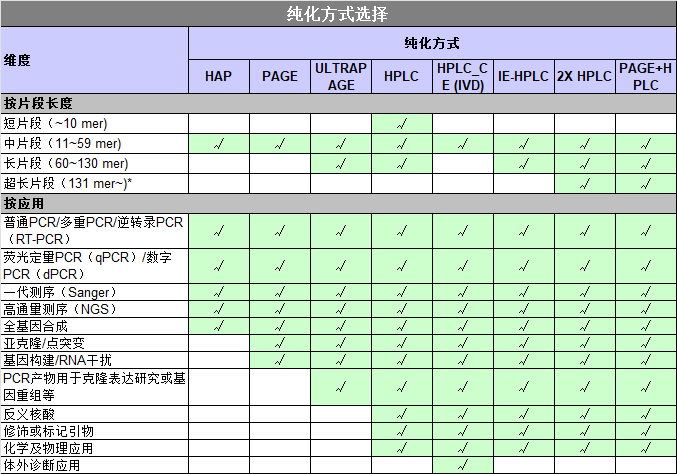
引物纯化方式有哪些,如何选择?(来自微信公众号)
脱盐
寡核苷酸合成后,为了纯化寡核苷酸成为天然的DNA结构,首先必须去除保护基团。通过浓氨水处理,合成的寡核苷酸从固相载体上分离,2-氰乙氧基–磷酸二脂键的保护基团,以及碱基的保护基团基(苯甲酰基和异丁基)被去除,从而形成了天然的DNA结构。然而,必要的去保护步骤完成后,寡核苷酸混合物还包含几种必须被去除的小分子有机化合物。
所有非必须有机化合物被移除的过程通常叫做脱盐。脱盐纯化可以借助反向硅胶柱进行。尽管脱盐纯化可以移除所有的非必须有机杂质,但它不能有效移除合成中产生微量的提前终止的寡核苷酸杂链。然而,脱盐的寡核苷酸还是能够满足PCR检测等基础生物研究。
BioRP/OPC纯化
如果寡核苷酸以“三苯甲基”的形式合成,则N-甲基寡核苷酸包含5’-DMT基团,提前终止的寡核苷酸不包含该基团。因为DMT基有强的亲脂的特性,有5’-DMT基团的寡核苷酸与反相树脂有亲和性,因此反相亲和树脂通常被用于寡核苷酸的纯化。利用反向树脂和5’-DMT寡核苷酸存在强亲和力,但是提前终止的寡核苷酸不包含DMT基团把想要的N-甲基寡核苷酸从提前终止的寡核苷酸杂质中分离出来。
HPLC
如果合成的寡核苷酸应用于克隆,定向诱变或定量的基因探测,那么对其纯度要求较高。脱盐或OPC纯化的寡核苷酸可能达不到要求,则HPLC纯化被广泛地用于这个目的。作为一种纯化树脂,阴离子交换树脂或反向树脂被用于寡核苷酸纯化。阴离子交换树脂的HPLC通常显示95-98%纯化效率,对于达到35-mer寡核苷酸的纯化是充分的。反向树脂化的HPLC与阴离子交换树脂的HPLC呈现相似的纯化效率。因为HPLC的纯化效率很大程度依靠寡核苷酸的长度,用HPLC法不能有效纯化长的寡核苷酸(大于35-mer)。
PAGE
对于长的寡核苷酸的纯化(50-100mer)推荐PAGE纯化法,它使用交连的聚丙烯酰胺凝胶(电泳)作为纯化基质。尽管PAGE显示出高的纯化效率(>98%),但它在额外的步骤方面有一些缺陷,比如在PAGE之后需要提取和脱盐,继而将导致纯化产率的下降。
选择什么纯化方式?
来自生工Sangon公司的引物提交表格: