0. 活体生物发光成像 (BLI)的原理
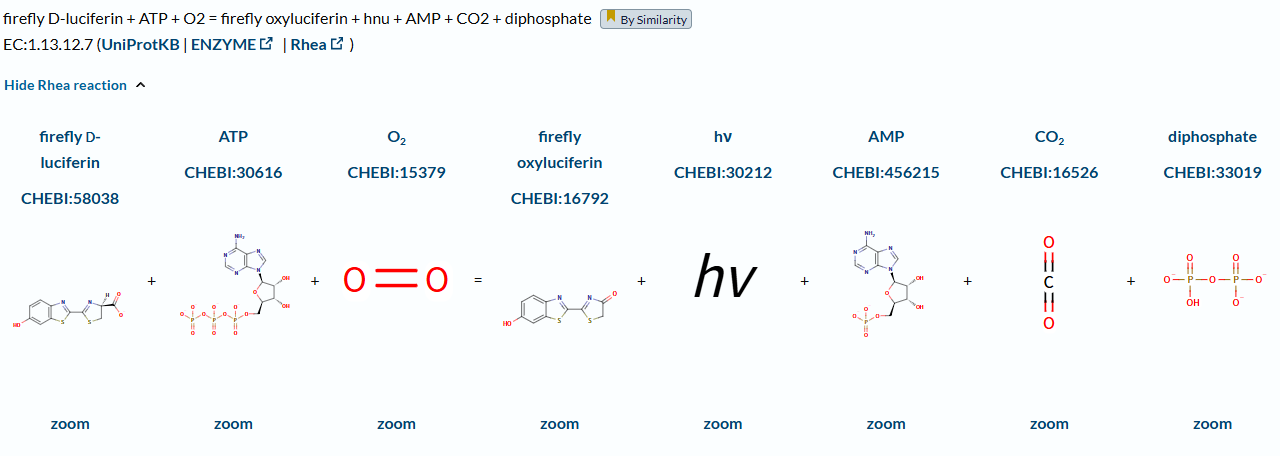
荧光素在ATP和氧气的作用下,发生氧化反应,产生CO2和氧化荧光素,并发出562nm的荧光。其辅因子是Mg2+,催化该反应的酶是荧光素单加氧酶Luciferin 4-monooxygenase
0.5 实验目的
以最常见的GL-261+c57的组合模型为例,利用小动物活体光学成像系统(如IVIS Spectrum),监测C57BL/6小鼠体内GL261-luc肿瘤的生长情况及生物发光强度。
1. 实验材料与试剂准备
1.1 核心试剂
- 底物: D-Luciferin, Potassium Salt (D-荧光素钾盐)。
- 配置方法: 用无菌DPBS溶解至 15 mg/mL。
- 过滤: 使用0.22 µm滤膜过滤除菌。
- 分装与保存: 避光分装(如1 mL/管,为方便可15ml一管),-20°C保存。切勿反复冻融。
- 麻醉剂: 异氟烷 (Isoflurane)。
- 脱毛膏/推毛剪: 针对C57黑鼠可有。
- 眼膏: 红霉素眼膏或金霉素眼膏(防止麻醉期间角膜干燥,我们可不使用)。
1.2 仪器设备
- 小动物活体光学成像系统 (IVIS Spectrum, Ami, 或类似设备)。
- 气体麻醉机及氧气源。
- 1 mL 注射器及 25G/26G 针头。
- 电子天平。
2. 实验前准备
2.1 脱毛处理
C57小鼠的黑色毛发和皮肤中的黑色素会吸收大量光子。成像前24小时进行脱毛可避免成像当天皮肤炎症干扰信号。颅内模型需剃除头顶至颈部的毛发;皮下模型剔除肿瘤周围至少1cm范围内的毛发。可先用推毛剪推去长毛,再涂抹脱毛膏(停留时间1-2分钟内,防止灼伤皮肤),温水擦拭干净。
2.2 仪器预热
- 打开成像系统软件,初始化仪器。
- CCD制冷: 确保CCD相机冷却至工作温度(通常为 -90°C),需等待约15-20分钟至Status变绿。
3. 实验操作步骤
3.1 称重与底物注射
- 称量小鼠体重(不称就估计20 g)。
- 底物剂量计算: 标准剂量为 150 mg/kg。
- 简便算法: 使用浓度为 15 mg/mL 的母液,按 10 µL/g 体重注射。
- 举例: 20 g 小鼠腹腔注射 200 µL 底物。
- 注射方式: 腹腔注射。注射后轻轻按摩腹部以助扩散。
- 计时开始: 注射底物的时间点记为 T=0。
3.2 动力学等待期
- 荧光素酶反应不是瞬间达到峰值的。腹腔注射后,底物需要时间被吸收、进入血液、穿透血脑屏障并进入细胞。 注射后,将小鼠放回笼中自由活动 10分钟。
- 注意: 多数GL261-luc模型的信号峰值出现在注射后 10-20分钟。如果为了获得极高精度的量化数据,建议第一次实验时对一只小鼠进行连续成像(每2分钟一次)以测定最佳峰值时间。常规实验通常统一在注射后7分钟。
3.3 麻醉诱导
- T=7 min:将小鼠放入麻醉诱导盒。
- 开启异氟烷:浓度 **3-4%**,氧气流速 1-2 L/min。
- 待小鼠翻正反射消失(约1-2分钟),涂抹眼膏保护角膜。
3.4 上机成像
- 转移小鼠: 将小鼠转移至成像舱内的温控载物台(37°C)。
- 维持麻醉: 将小鼠鼻子对准麻醉面罩,异氟烷浓度调至 1.5-2% 维持。
- 摆位:俯卧位 (Prone)。确保头部水平,不要歪斜。
- 参数设置:
- Imaging Mode: 生物发光或化学发光。
- Exposure Time: 建议选 **Auto (自动)**。早期肿瘤信号弱,可能需要60s;晚期肿瘤信号强,1s都可能过曝。Auto模式能防止信号饱和。
- Binning: 早期/微小转移:Medium (8) 或 High (16), 灵敏度高,分辨率低。晚期大肿瘤Small (4) 或 Medium (8)。
- F/Stop (光圈): 1 ,光圈最大,进光量最多。
- Field of View (FOV): 根据小鼠数量选择,通常3-5只/次。
- 采集图像。
3.5 图像检查
- 检查图像是否有饱和点:软件通常以红色或紫色高亮显示饱和区域。如果出现饱和,必须缩短曝光时间重拍,否则数据无效。
- 检查是否在信号峰值期:如果是第一次做该细胞系,建议间隔5分钟再拍一张,确认信号没有剧烈衰减。
3.6 实验结束
- 关闭麻醉气体,取出小鼠。
- 将小鼠置于复苏区,待其完全苏醒、走动正常后放回笼盒。用70%酒精擦拭成像舱内部及麻醉面罩。
4. 数据分析
使用配套软件进行分析:
- 单位选择:不要使用 Counts (原始计数)。使用 Radiance (p/sec/cm²/sr) 或 Total Flux (photons/sec)。 Radiance 归一化了曝光时间、Binning和光圈大小,使得不同日期的实验数据可以互相比较。
- 圈选感兴趣区 (ROI): 使用 Circle 或 Contour 工具圈出头部肿瘤区域。保持ROI大小在不同小鼠间相对一致,或覆盖所有信号区域。在小鼠身体无信号部位圈一个相同大小的ROI作为本底,通常软件会自动扣除。
- 数据导出: 导出 Total Flux (p/s) 数据至 Excel 进行统计作图。
5. 常见问题
| 问题现象 | 可能原因 | 解决方案 |
|---|---|---|
| 信号极其微弱 | 1. 黑色素遮挡 2. 肿瘤太小/细胞丢失质粒 3. 颅骨遮挡 |
1. 确保脱毛彻底。C57皮肤本身也有色素,信号永远比裸鼠弱,这是正常的。 2. 重新检测细胞的Luc活性。 3. 增加Binning值 (至8或16)。 |
| 信号弥散/全身都有 | 1. 底物腹腔注射误入肠道/皮下 2. 肿瘤发生脊髓或全身转移 |
1. 注射需准确,回抽无空气/液体再推药。 2. 检查尾部静脉或脊柱信号。 |
| 背景噪音过高 | 1. 饲料含荧光物质 2. 笼盒污染 |
1. 换饲料。 2. 清洁成像舱,用黑布遮盖成像仪防止漏光。 |
| 不同天数数据波动大 | 注射到底物起效的等待时间不一致 | 每次都在注射后T=7 min麻醉,T=12-15 min成像,绝不随意更改时间窗。 |
