实验原理
细胞复苏是通过快速融化的手段保证细胞外结冰晶在很短时间内融化,避免由于缓慢融化使水分渗入细胞重新结晶对细胞造成损害,复苏成功的细胞可以保持很高的活力,也可以避免长时间常温下DMSO对细胞产生毒性。
仪器和试剂
- 仪器:水浴锅、台式离心机、细胞计数仪、CO2培养箱、倒置显微镜、移液枪、移液管移液器、细胞培养瓶
- 试剂:细胞培养基、双抗、FBS、PBS、75%酒精。
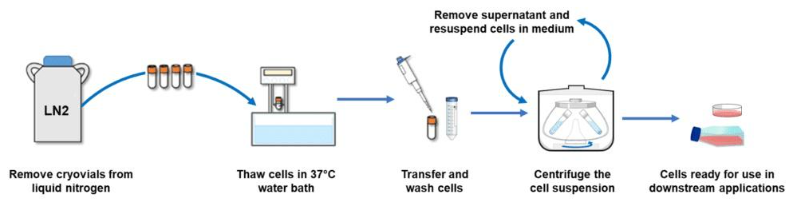
实验步骤
- 将水浴锅预热至37℃,超净工作台使用前紫外线照射30 min,打开通风,用75% 酒精擦拭台面,保持台面干净整洁。
- 配制完全培养基50mL:如U87为MEM-EBSS(MEM Eagles with Earle's Balanced Salts) +10%FBS+1% NEAA
- 取一只15mL离心管,加入7mL培养基,37℃培养箱预热。
- 从-80℃冰箱中取出细胞冻存管,迅速转移至水浴锅中化冻,不时摇动,加速其融化至还有一小块冰(直径3-4mm)时停止复苏,尽量保持冻存管的管口不浸入水中。喷洒酒精后转移至生物安全柜。
- 用酒精棉球擦拭冻存管,用镊子拧开瓶盖。取适量预热后的培养基加入冻存管混匀后加至离心管中 (保留枪头),另取2mL新鲜培养基冲洗原管及瓶盖,颠倒混匀,将洗液也转移至离心管中。(若细胞较珍贵,在吸取细胞时要保留枪头或移液管,用培养基冲洗上面残留的细胞)
- 室温下以1000-1500 rpm的转速将细胞悬液离心 5 min并弃上清(若细胞耐受冻存液,可以不离心)。
- 弃去上清液,轻轻敲击离心管底部使细胞散开,用1 mL 左右培养基重悬细胞,并转移培养皿/培养瓶中,加入对应量的培养基,摇晃均匀,放入37℃ 恒温细胞培养箱中。
- 过夜后(~12h),观察复苏细胞的状态,并及时更换培养基一次,并依据情况,决定是否需要重新冻存细胞保种。
- 悬浮细胞操作同上,培养基使用悬浮细胞培养基,培养皿为细胞培养瓶,37℃ 细胞摇床(5% CO2)、110 rpm。
